TP N°0 - Quimica
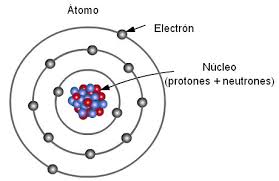
El Átomo
Modelo Atómico
Mueva el puntero del Mause o hacer clic para empezar en el Simular ONLINE
Tabla periódica de los elementos químicos
Enlace covalente
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel1 (excepto el Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen entre átomos de un mismo elemento no metal y entre distintos elementos no metales.
Cuando átomos distintos de no metales se unen una forma covalente, uno de ellos resultará más electronegativo que el otro, por lo que tenderá a atraer la nube electrónica del enlace hacia su núcleo, generando un dipolo eléctrico. Esta polarización permite que las moléculas del mismo compuesto se atraigan entre sí por fuerzas electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos. Las moléculas entre sí poseen prácticamente una atracción nula.
En síntesis, en un enlace iónico, se produce la transferencia de electrones de un átomo a otro y en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir, se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
Tipos de sustancias covalentes:
Existen dos tipos de sustancias covalentes:
El benceno es un ejemplo de una sustancia covalente molecular.
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
· Temperaturas de fusión y ebullición bajas.
· En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos.
· Son blandos en estado sólido.
· Son aislantes de la corriente eléctrica y el calor.
· Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (lo semejante disuelve a lo semejante).
· Ejemplos: dióxido de carbono, benceno, oxígeno, nitrógeno.
Redes o sustancias covalentes reticulares: Además, las sustancias covalentes forman redes cristalinas de un número indefinido de átomos, semejantes a los compuestos iónicos, que tienen estas propiedades:
· Elevadas temperaturas de fusión y ebullición.
· Son sólidos en Condiciones Normales.
· Son sustancias muy duras.
· Son aislantes (excepto el grafito).
· Son insolubles.
· Ejemplos: cuarzo, diamante.
Consiste en la formación entre átomos de diferentes elementos, y la diferencia de la electronegatividad debe ser mayor de 0,8. En este enlace, los electrones son atraídos fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo).
Enlace covalente no polar.
Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy pequeña (menor que 0,8). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme
| Sustancias no polares | Sustancias polares |
|---|---|
| Etano | Metanol |
| Tolueno | Fenol |
| isobutano | Acetona |
| n-Pentano | Ácido Propinoico |
Distintos tipos de enlaces covalentes.
· Enlace simple: es un par electrónico compartido formado por un electrón perteneciente al último nivel de energía de cada átomo y se representa con una línea. Ejemplos: H-H, Cl-Cl
· Enlace doble: Formado por dos pares electrónicos compartidos, es decir por dos electrones pertenecientes al último nivel de energía de cada átomo y se representa con dos líneas paralelas. Ejemplo: O=O
Enlace covalente doble.
· Enlace triple: Formado por tres pares electrónicos compartidos, es decir por tres electrones pertenecientes al último nivel de energía de cada átomo y se representa con tres líneas paralelas. Ejemplo: N≡N
Enlace covalente triple.
· Enlace covalente dativo o de coordinacion: Es un par electrónico compartido por dos átomos pero ambos electrones son aportados por el mismo átomo. Se suele representar con una flecha (→).
Un ejemplo de una especie química que posee un enlace coordinado, el cual es el ion amonio (NH41+). El Ion amonio está constituido por un protón y amoniaco. Los compuestos en los que se encuentra un enlace coordinado se conocen con el nombre de compuestos de coordinación. Los Compuestos de coordinación o también denominados complejos, los cuales en su mayoría de los casos están unidos a varios aniones circundantes conocidos como ligandos.
CONCLUSIÒN:
En este tipo de enlace nos muestra como se cumple la regla del octeto en los enlaces covalentes polares y no polares, como en los polares que son los elementos distintos en el cual uno tiene carga positiva y el otro un negartiva, y en los no polares son dos atomos iguales que se unen.











Comentarios
Publicar un comentario